Início »
Controle de contaminantes em LC e LC-MS

O controle de contaminantes em LC e LC-MS, é sempre um dos desafios com qual nos deparamos em nossa rotina laboratorial.
Mas por que é importante controlar os contaminantes nas análises cromatográficas? Os agentes não desejáveis podem causar efeitos distintos nas análises e os principais efeitos negativos são:
- Redução da sensibilidade: devemos lembrar que a sensibilidade está diretamente relacionada aos limites de detecção (sensibilidade é a relação entre o sinal e o ruído);
- Aparecimento de picos fantasmas: picos que aparecem no meio do cromatograma interferindo em suas análises;
- Baixa relação sinal ruído: geralmente é acarretada por alto nível de ruído, que por sua vez, pode ser proveniente de contaminação;
- Supressão iônica (nos MSs): devido a uma competição entre o contaminante e sua molécula de interesse durante a ionização;
- Dificuldade de detecção de níveis baixos de concentração;
- Aumento de ruído em volta das massas de interesse;
- Redução do sinal de sua massa de interesse por supressão ou formação de adutos.
Uma definição de contaminação para contribuir no entendimento: Contaminação em cromatografia é a presença de um agente químico desconhecido ou conhecido capaz de gerar uma alteração na linha de base de detecção ao ponto de inibir a detecção ou de aumentar o sinal da mesma. Incluindo: Picos fantasmas, ruído químico (não eletrônico) e massas não desejáveis ou série de massas não desejáveis observadas em um espectro (para os MSs).
Fonte de contaminação interna (amostra)
As fontes de contaminação podem ser provenientes de vários lugares, umas das formas de contaminação entre amostras é o carryover, mas o que é carryover? O carryover é a contaminação entre diferentes injeções, ao realizar a aquisição de uma corrida cromatográfica e a corrida cromatográfica subsequente apresenta eluição de um analito inesperado ou com aumento da concentração do mesmo analito esperado.
Uma maneira bastante eficiente para identificar se a contaminação é proveniente de carryover da injeção anterior, é realizar a injeções de branco em sequencia (2 ou 3x) imediatamente após a injeção de seu padrão, caso o composto de interesse (ou contaminante) apareça em suas injeções de branco e a intensidade diminui com a sequencia de injeção de brancos, o carryover está ocorrendo e poderá ser prejudicial a suas análises de rotina.
A boa notícia é que com o controle de contaminantes para LC e LC-MS proveniente de injeções anteriores pode ser feito e a maneira mais eficiente de eliminar tal contaminação é ser acertivo na escolha do solvente de limpeza do seus sistema de injeção e diminuir a concentração das amostras com uma diluição adequada. Há dois tipos de carryover:
Concentração da amostra injetada – Diluição: baseado em uma injeção ou infusão de altas concentrações da sua amostra ou padrão, pode ser limpo do sistema com a injeção de branco em sequência, conforme o número de injeção de branco é executado a intensidade do contaminante é diminuída. A principal causa desse tipo de contaminação é o uso de concentração errada para o sistema cromatográfico.
Características da amostras injetada – Adsorção: esse tipo de contaminação tem duas características aparecem lentamente e de maneira randômica, são substâncias que ficam presas a coluna cromatográfica ou em alguma parte do sistema. É possível realizar a limpeza tanto da coluna quanto do sistema, mas geralmente é uma limpeza lenta e difícil de ser feita, uma investigação mais minuciosa deve ser feita para identificar a causa e a parte problemática.
A contaminação de uma maneira geral, pensando idealmente, é melhor que seja evitada. Sabemos que na prática nem sempre é possível, já que, mais que um usuário utiliza o sistema cromatográfico, há várias metodologias diferentes aplicadas no mesmo sistema cromatográfico, os preços de solventes com alta pureza não são baratos.
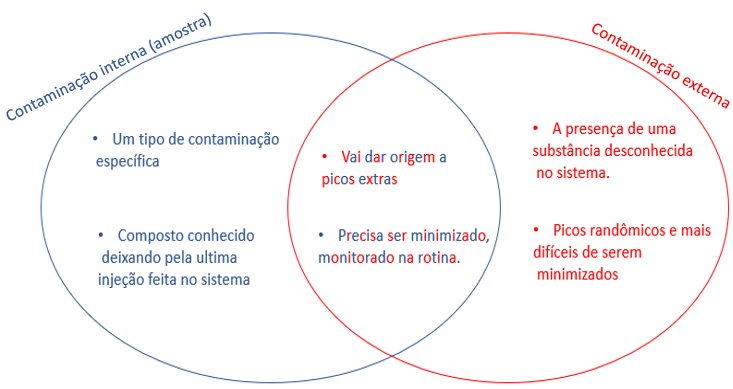
Fonte de contaminação externa
As contaminações externas são provenientes dos solventes, aditivos, vidraria sujas, partículas, crescimento microbiano na fase móvel e etc. Seguem recomendações gerais para evitar contaminantes ou elimina-los de suas análises:
- Use solventes limpos e livres de partículas. Ao preparar a fase móvel, use agentes químicos limpos, de fabricantes de confiança, reagentes livres de partículas. Solventes grau LC ou LCMS são ideais, todos os materiais utilizados para o preparo da fase móvel devem estar limpos e livres de resíduos de detergentes;
- O uso de água ultra pura, utilizar um sistema de purificação de água adequado, capaz de remover íons, partículas e microorganismos. A água ultrapura deve ser estéril e com partículas menores que 0,2µm, com resistividade melhor que 18 Mohm-cm, baixa absorbância UV e teor total de carbonos abaixo de 5 ppb (TOC). O uso de água nas condições mencionadas garante a vida útil maior da coluna cromatográfica e menor ruído da linha de base;
- Uso de soluções recém preparadas, recomenda-se a substituição da fase móvel com frequência, 24 a 48h, dessa maneira será evitado o crescimento microbiano e o acúmulo de partículas. Além disso, é importante ficar atento à validade dos solventes utilizados, a origem de partículas precipitadas e contaminantes podem ser provenientes daí;
- A prevenção do crescimento microbiano merece um capítulo à parte. A fase móvel aquosa é susceptível ao crescimento microbiano e tal crescimento irá causar aparecimento de picos fantasmas, bloqueio de filtros do sistema cromatográfico, entupimento da coluna, variação de pressão. De fato, o crescimento microbiano para o sistema LC ou LC-MS é um desastre. Para evitar o crescimento microbiano troque o solvente aquoso em até 24 horas após o preparo. Sempre que o sistema cromatográfico vai ficar parado, evite que a linha de solvente aquoso fique completamente preenchida com 100% de água, use uma solução com no mínimo 10% de solvente orgânico, assim evitará o crescimento microbiano;
- Minimize o uso de aditivos: Com o objetivo de reduzir o sinal de fundo, use sempre a menor concentração possível de aditivos na fase móvel. O uso de aditivos nas fases móveis está relacionado a separação cromatográfica, atualmente as tecnologias das colunas estão muito evoluídas, então dê sempre preferência pela escolha de colunas cromatográficas com tecnologia mais modernas, assim não precisarão de adição de aditivos antes usados para resultados cromatográficos satisfatórios. Por exemplo, o uso de trietanolamina (TEA) não é mais necessário o uso para obtenção de picos simétricos para compostos básicos, atualmente colunas como a tecnologia CSH resolverão seu problema;
- Use aditivos da melhor qualidade;
- Use aditivos com quantidades baixas de metais e íons metálicos. Por exemplo, dê preferência ao uso de ácido fórmico ao invés de ácido acético, pois ácido acético pode conter quantidades significativas de íons metálicos;
- Para prevenir precipitação no sistema cromatográfico, evite o uso de sais inorgânicos e aditivos em solventes orgânicos. Como já sabemos, o uso de altas concentrações de solventes orgânicos pode gerar precipitação de sais;
- Use aditivos voláteis e compatíveis com o espectrômetro de massas. Sais contendo amônia são mais indicados. Por exemplo: Acetato, formiato e carbonato de amônia;
- Quando realizar a substituição da fase contendo aditivo, realize uma purga e limpeza da linha com água por 5 minutos. Em seguida, use uma solução contendo pequena porcentagem de solvente orgânico (10%) livre de aditivos;
- Exemplo de aditivos não voláteis que devem ser evitados em análises por LC-MS: Fosfatos (PO4 -3), Boratos (BO4-3), Sódio (Na+);
- Os aditivos voláteis podem evaporar e a sua respectiva concentração será mudada, acarretando em uma alteração nas características da fase móvel e alteração dos resultados esperados nas análises cromatográficas;
- O pH da fase móvel muda com a absorção de CO2. Se alterar o pH da solução de fase móvel, também vai alterar os resultados em sua análise;
- Use solventes miscíveis: Tenha certeza ao preparar as fases móveis que os solvente são miscíveis e que os aditivos usados são miscíveis também. Caso não sejam uma precipitação irá acontecer e além dos efeitos indesejáveis para o sucesso da metodologia analítica, o sistema também poderá ser danificado;
- Armazenamento dos solventes devem ser em frascos de vidros borosilicato 3.3, limpos, com tampas e cobertos. Os frascos sempre devem ser cobertos para evitar que partículas caiam nos solventes. Os frascos devem ser cobertos com tampas apropriadas ou alumínio;
- Não use plástico filme ou parafilm para tampar os frascos;
- Evite o uso de frascos de tamanhos que não são compatíveis com o volume de solução que será usado na análise. Por exemplo, não use frascos de 1 litros para armazenar soluções de volume pequenos como 250mL. Outra dica, não prepare volumes muito grandes quando for utilizar volumes pequenos na metodologia e execução dos trabalhos, assim, será necessário refazer as soluções com frequência e isso evita problemas cromatográficos e ao sistema;
- Não utilize frascos marrons que não são apropriados para armazenar solventes. Evite reutilizar frascos que foram adquiridos com reagentes;
- Nunca armazene ou prepare soluções em frascos de plástico, provetas de plásticos ou bérqueres de plástico. Esses frascos podem liberar plasticidas (por exemplo, ftalatos), consequência: picos fantasmas no cromatograma;
- Quanto mais tempo uma solução ficar dentro de um frasco, maior é a extração de contaminantes do próprio frasco. Por isso é tão importante a substituição da fase móvel com frequência.
- Evite filtrar os solventes provenientes de fabricantes de confiança. Não há a necessidade de filtrar um solvente recebido lacrado dos fornecedores. A probabilidade de você contaminar o solvente durante a filtração é maior do que utilizar o solvente diretamente para o preparo da fase móvel.
- Umas das principais fontes de contaminação é a própria limpeza dos materiais utilizados para preparar a fase móvel ou as amostras de interesse.
DICA DA MATRIX: Para o controle de contaminantes para LC e LC-MS, deixe a vidraria usada nos sistemas LC-MS separadas. Utilize sempre a mesma vidraria no preparo de fase móvel, no preparo de soluções em geral e no preparo de amostras. Não utilize detergente na limpeza das vidrarias.

Como posso realizar a limpeza das vidrarias aplicadas ao preparo de amostras e ao preparo de fase móvel:
- Rince os frascos com solvente orgânico e água ultrapura;
- Nunca limpe os frascos com detergente ou em uma lava louças;
- Armazene os frascos e materiais usados para preparar ou armazenar fase móvel separadamente dos demais materiais do laboratório;
- Quando houver suspeita de contaminação proveniente da vidraria, uma limpeza mais agressiva pode ser necessária;
- Coloque o frasco no ultrassom com 10% de ácido fórmico ou ácido nítrico. Depois, rince bem com água e na sequência com metanol ou acetonitrila;
- Faça o passo anterior por mais duas vezes;
- Caso o problema de contaminação seja proveniente de crescimento microbiano, leve a vidraria para tratamento com esterilização via autoclave, verificando, sempre, antes do procedimento, o que pode e o que não pode ser autoclavado;
MATRIX LCMS – A melhor experiência para o seu laboratório
Baixe nosso catálogo atualizado.
Fale com um consultor especializado via Whatsapp
Acompanhe nossas redes sociais e fique por dentro das novidades: Instagram | Facebook | Linkedin
Conheça os melhores equipamento de cromatografia líquida | espectrometria de massas | análises térmicas
Leia também nossos artigos sobre:
- Micropipetas
- Tubos Falcon
- Banho Ultrassônico
- Cuidados com solventes na cromatografia líquida
- Contaminantes X Vidraria de laboratório
- HPLC ou CLAE – Cromatografia Líquida de Alta Eficiência
- Balanças Analíticas
